Alessandro Volta k sestrojení svého vodivého článku použil dvě vodivé desky, tzv. elektrody a mezi ně umístil kyselé prostředí – vodivý roztok nebo–li elektrolyt (z řeckého lytikós – určený k rozpouštění). Stejný pokus můžeme vyzkoušet s destilovanou vodou. Elektrody připojíme přes ampérmetr ke zdroji stejnosměrného napětí. Zjistíme, že obvodem neprochází žádný nebo jen nepatrný proud. Jestliže do vody přidáme malé množství např. kuchyňské soli, proud v obvodu se podstatně zvětší. Pokus svědčí o tom, že přidáním soli, ale také kyseliny nebo zásady do vody vzniká vodivý roztok – elektrolyt. Elektrolyty označujeme jako vodiče II. třídy, protože při průchodu proudu dochází současně k přenosu látky.
Ne všechny roztoky vedou elektrický proud. Např. vodný roztok cukru nebo alkoholu je nevodivý. Ani čisté látky nejsou dobrými vodiči. Příkladem může být destilovaná voda. Schopnost rozpouštědel vytvářet vodivé roztoky závisí na jejich relativní permitivitě. Čím je relativní permitivita vyšší, tím je schopnost rozpouštědla vytvářet vodivé roztoky lepší. Např. voda má εr = 81, kdežto toluen jen εr = 2,4, takže toluen vodivé roztoky prakticky nevytváří.
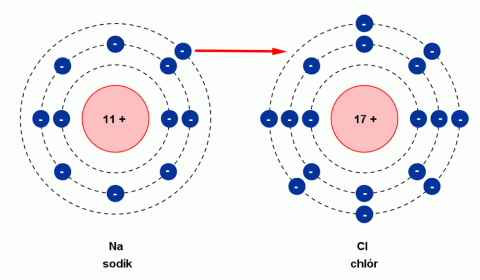
Vznik kladného iontu sodíku a záporného iontu chlóru.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Molekula NaCl vzniká sloučením atomu sodíku Na s atomem chloru Cl. Při vzniku molekuly NaCl přešel elektron z elektronového obalu atomu sodíku do elektronového obalu atomu chloru. To má za následek vznik dvou částic s nábojem – iontů (název iont pochází od Michaela Faradaye). Atom sodíku přitom odevzdal jeden elektron a vytvořil kladný iont (Na+). Atom chloru jeden elektron přijal a vytvořil záporný iont (Cl-). Ionty s opačnými náboji se přitahují elektrickými silami a vytvářejí pravidelnou strukturu krystalu chloridu sodného – tzv. iontovou vazbu.
Co se stane, když krystaly NaCl vsypeme do vody? Voda má velkou hodnotu relativní permitivity, a proto se zmenší elektrická síla působící na ionty Na+, Cl- v krystalu NaCl a ty se z krystalu uvolňují. NaCl se ve vodě rozpouští a probíhá děj zvaný elektrolytická disociace. Ionty Na+ a Cl- se uvolňují z krystalu a volně se pohybují v roztoku, vzniká roztok s kladnými a zápornými částicemi, elektrolyt. Elektrolyty vznikají také disociací kyselin a hydroxidů ve vodě. Iontová vodivost se uplatňuje nejen u roztoků látek, ale významné technické využití mají i taveniny různých solí zahřátých na vysokou teplotu.
Samotná existence volných nosičů náboje – iontů – však pro vznik elektrického proudu nestačí. V elektrolytu je třeba vytvořit elektrické pole, které působí elektrickými silami na ionty a uvádí je do uspořádaného pohybu.

Rozdělení molekuly NaCl pomocí elektrického proudu.
Zdroj: Techmania Science Center. Autor: Magda Králová. Under Creative Commons.
Elektroda spojená s kladným pólem zdroje se nazývá anoda a elektroda spojená se záporným pólem zdroje je katoda. Poněvadž působením elektrického pole v elektrolytu se směrem k anodě pohybují záporné ionty, označujeme je jako anionty. Podobně označujeme kladné ionty názvem kationty. Kladně nabité ionty sodíku jsou přitahovány k záporné elektrodě, kde přijmou jeden elektron a stanou se neutrálním atomem sodíku. Společně s molekulou vody se sloučí na hydroxid sodný NaOH. Záporně nabité ionty chlóru budou přitahovány ke kladně nabité elektrodě, kde odevzdají jeden elektron, stanou se neutrálními atomy chlóru, který uniká v podobě plynného chlóru Cl2. Účinkem stejnosměrného proudu dochází k rozkladu elektrolytu.
Výsledný elektrický proud v elektrolytu závisí na jeho teplotě, protože s rostoucí teplotou se pohyblivost iontů zvyšuje. Závisí také na koncentraci roztoku, protože s rostoucí koncentrací vodivost roztoku roste až k maximální hodnotě, pokud se roztok nestane nasyceným.
